Определите степень диссоциации муравьиной кислоты в ее...
Задание:
Определите степень диссоциации муравьиной кислоты в ее 0,46 %-ном (по массе) водном растворе (плотность раствора 1г/мл), если суммарная концентрация всех частиц, образованных муравьиной кислотой (молекул и ионов) в растворе равна 0,11 моль/л.
Решение:

1) Пусть имеется 1 л раствора. Вычисляем количество вещества муравьиной кислоты и суммарное количество вещества всех частиц в растворе:
v(частиц) = С(частиц) · V(раствора) = 0,11 · 1 = 0,11 моль.
m(раствора) = V(раствора) · ρ(раствора) = 1000 г.
m(НСООН) = m(раствора) · ω(НСООН) = 1000 · 0,0046 = 4,6 г.
n(НСООН) = m(НСООН) / М(НСООН) = 4,6 / 46 = 0,1 моль.
2) Пусть продиссоциировало х моль НСООН, тогда непродиссоциировавшими осталось 0,1 – х моль кислоты и образовалось х моль ионов НСОО- и х моль ионов Н+ :
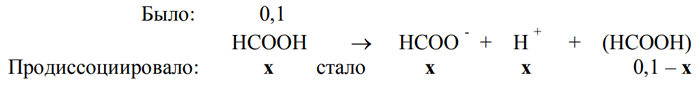
Общее количество вещества частиц в растворе = х + х + 0,1 – х = 0,1 + х
0,1 + х = 0,11; х = 0,11 – 0,1 = 0,01.
3) Определяем степень диссоциации:
α = v(продиссоциировавших молекул) / v(исходных молекул) = х / 0,1 = 0,01 / 0,1 = 0,1 (10 %)
Ответ: α(НСООН) = 10 %