Осадок, образовавшийся после смешивания растворов, содержащих...
Задание:
Осадок, образовавшийся после смешивания растворов, содержащих 6,8 г хлорида цинка и 5,85 г сульфида натрия, обработали избытком соляной кислоты. Выделившийся газ сожгли в избытке кислорода, и продукты сгорания растворили в избытке раствора гидроксида натрия. Определите массу образовавшейся соли.
Решение:

1) Рассчитаем количества веществ, содержавшихся в исходных растворах:
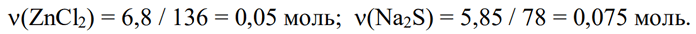
2) Запишем все уравнения происходящих химических реакций, определим какое из исходных веществ было в недостатке, и проставим количества реагирующих и образующихся веществ:
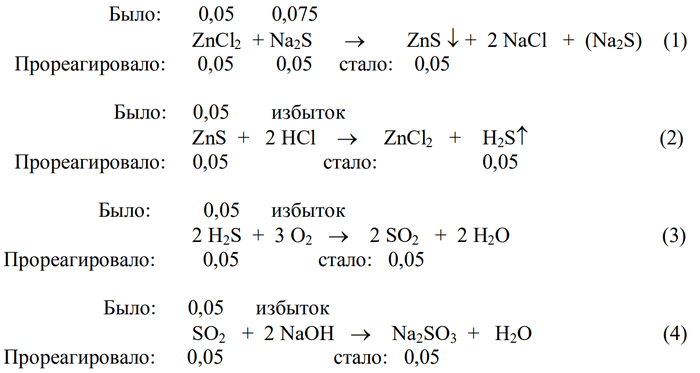
По первому уравнению реакции один моль хлорида цинка реагирует с одни молем сульфида натрия. Согласно условию задачи количество вещества сульфида натрия больше количества вещества хлорида цинка, поэтому последний находится в недостатке, и все расчеты производятся по нему. Из последовательности реакций, записанной вышеприведенным образом видно, что конечного продукта (сульфита натрия) образуется столько же, сколько было хлорида цинка (0,05 моль).
3) Определяем массу сульфита натрия:
m(Na2SO3) = n(Na2SO3) · M(Na2SO3) = 0,05 · 126 = 6,3 г.
Ответ: m(Na2SO3) = 6,3 г.