В сосуд емкостью 5,6 л, заполненный при нормальных условиях...
Задание:
В сосуд емкостью 5,6 л, заполненный при нормальных условиях азотом, поместили 37 г смеси нитрата натрия и карбоната кальция. Сосуд закрыли и нагревали до полного разложения содержавшихся в нем солей. Определите массы веществ в твердом остатке после прокаливания и состав (в % по объему) газовой смеси, находящейся в сосуде после разложения солей, если известно, что ее плотность по кислороду равна 1,08.
Решение:

1) Рассчитываем количество вещества азота, находившегося в сосуде и среднюю молярную массу образовавшейся газовой смеси:
v(N2) = V(N2) / 22,4 = 5,6 / 22,4 = 0,25 моль. Мср. = DO2 · М(О2) = 1,08 · 32 = 34,56 г/моль.
2) Пусть в исходной смеси было х моль нитрата натрия и у моль карбоната кальция.
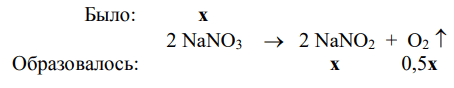
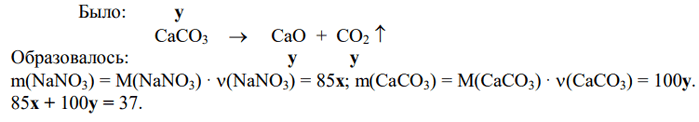
3) v(газов в образовавшейся смеси) = v(N2) + v(O2) + v(CO2) = 0,25 + 0,5х + у.
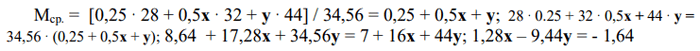
4) Составляем систему уравнений и решаем ее:
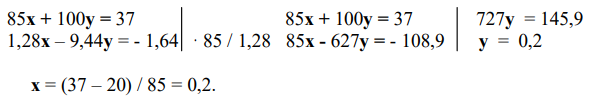
5) Находим объемные доли газов в смеси и массы образовавшихся твердых продуктов:
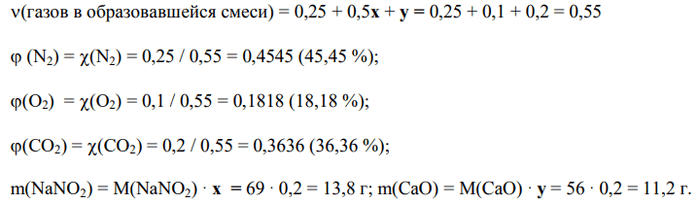
Ответ: φ(N2) = 45,45 %; φ(O2) = 18,18 %; φ(CO2) = 36,36 %; m(NaNO2) = 13,8 г; m(СаО) = 11,2 г