Медный купорос массой 30 г растворили в воде...
Задание:
Медный купорос массой 30 г растворили в воде. К образовавшемуся раствору сначала прилили 48 г 15%-го раствора гидроксида натрия, а затем в него погрузили цинковую пластинку массой 8,45 г и выдерживали до тех пор, пока ее масса не перестала изменяться. После этого пластинку вынули и прокалили в токе кислорода. Определите массовые доли веществ в смеси, полученной после прокаливания.
Решение:
Запишем уравнения реакций, протекающих до внесения пластинки:
CuSO4·5H2Oтв.→ CuSO4 р-р + 5H2O (процесс растворения купороса, можно не записывать)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Проведем вычисления по этим реакциям.
n(CuSO4·5H2O) = n(CuSO4) = 30 : 250 = 0,12 моль
m(NaOH) = 48 · 0,15 = 7,2 г
n(NaOH) = 7,2 : 40 = 0,18 моль
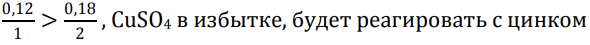
Запишем оставшиеся реакции и вычислим состав смеси после прокаливания:
Zn + CuSO4 = ZnSO4 + Cu
2Cu + O2 = 2CuO
2Zn + O2 = 2ZnO
n(CuSO4 прореаг.) = 0,5n(NaOH) = 0,09 моль
n(CuSO4 ост.) = n(Cu) = n(Znпрореаг) = n(CuSO4 исх.) – n(CuSO4 прореаг.) = 0,12 – 0,09 = 0,03 моль
n(Znисх.) = 8,45 : 65 = 0,13 моль
n(Znост.) = n(Znисх.) – n(Znпрореаг) = 0,13 – 0,03 = 0,1 моль
n(ZnO) = n(Znост.) = 0,1 моль, m(ZnO) = 0,1 · 81 = 8,1 г
n(CuO) = n(Cu) = 0,03 моль, m(CuO) = 0,03 · 80 = 2,4 г
ω(ZnO) = 8,1 : 10,5 · 100% = 77,14%; ω(CuO) = 2,4 : 10,5 · 100% = 22,86%
Ответ: 77,14%; 22,86%